دنیای کاردستی
اموزش اوریگامی ستاره خوش شانسی

اوریگامی ستاره خوش شانسی که به ستاره اقبال نیز معروف است از پر طرفدار ترین مدل های اوریگامی است که ساختن آن کار بسیار ساده ای است و میان کودکان و بزرگسالان محبوب است. از این اوریگامی در تزیین اتاق خواب کودکان و نوزادان، در جشن های تولد و فارغالتحصیلی، سالگرد ازدواج و دیگر مراسمات و میهمانی ها استفاده میشود.
لوازم مورد نیاز:
- یک ورق A4 یا کاغذ نامه (مطابق تصویر از لبه های کاغذ برش های پهن و بلند بزنید)
- قیچی
- در نظر داشته باشید که هر چقدر عرض کاغذ برش خورده (نوار کاغذی) بیشتر باشد ستاره اوریگامی بزرگ تر خواهد بود، پس مطابق سلیقه عرض کاغذ را انتخاب کنید
- پیشنهاد ما به شما این است که کاغذ ها را به عرض 1 تا 3 سانتی متر و طول 20 سانتی متر برش بزنید
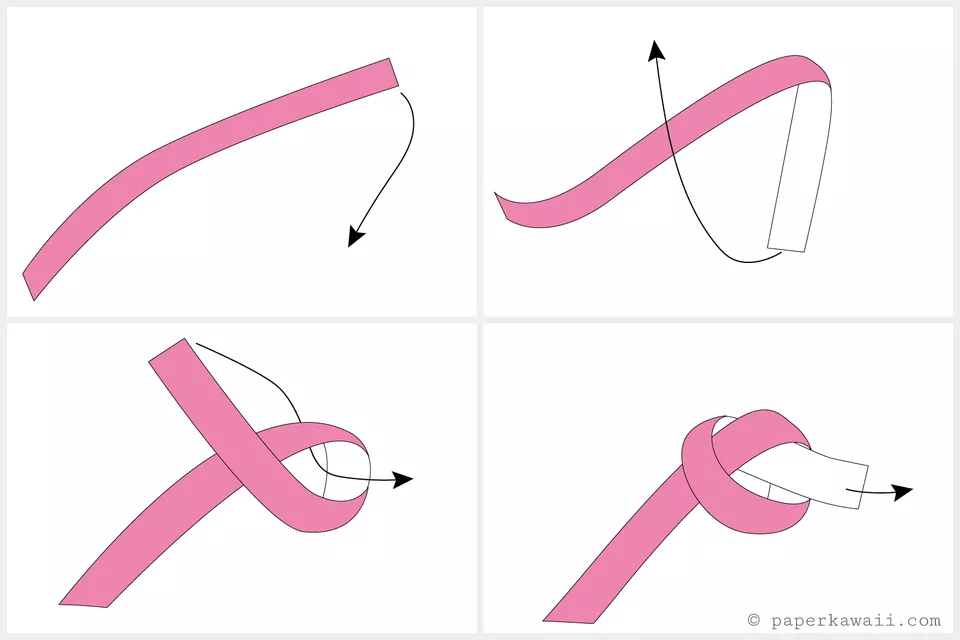
قدم اول:
- با طرف رنگی کاغذ شروع کنید
- طرف راست کاغذ را به طرف پایین بیاورید
- انتهای نوار کاغذی را به طرف بالا و سمت چپ بیاورید
- انتهای نوار کاغذی را از حفره ایجاد شده رد کنید
- دو سر کاغذ را به آرامی بکشید تا یک گره کامل بوجود بیاید
- در انجام این مرحله عجله نکنید بلکه با دقت و ظرافت انجام دهید تا مدل بی نقض شود
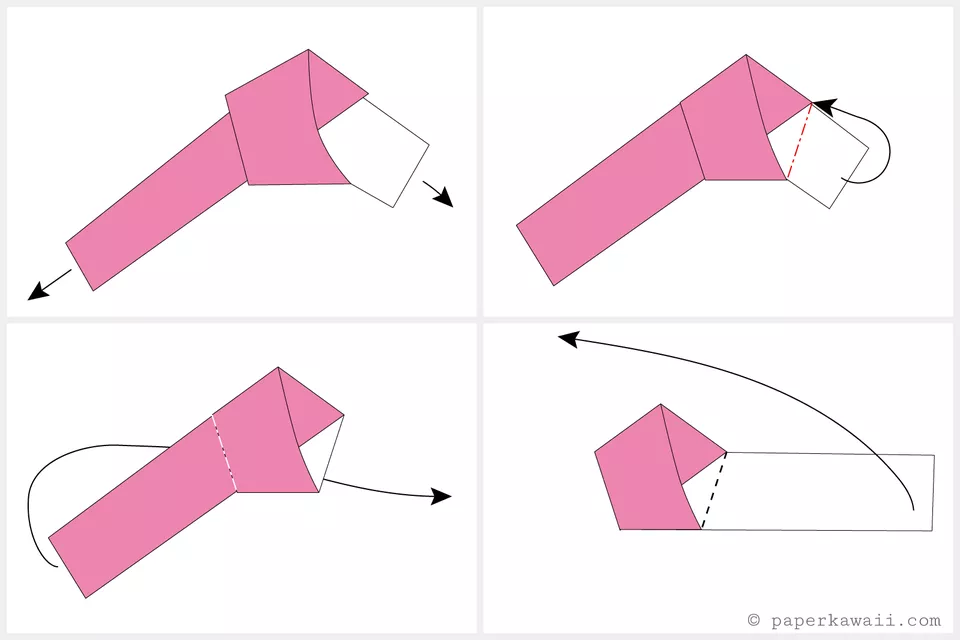
قدم دوم:
- انتهای رنگی رد طرف چپ این گره باید بلند تر از انتهای دیگر آن در طرف راست باشد
- طرف سفید در سمت راست را به پشت تا بزنید، نیازی نیست آن را ببرید ولی اگر خیلی بلند است میتواندی آن را با قیچی کوتاه کنید
- طرف باقی مانده در سمت چپ را به پشت برگردانید و مدل را نیز برگردانید
- به پیچاندن پنج وجهی ادامه دهید
- نوار کاغذی را از بخش بالا به طرف چپ تا بزنید
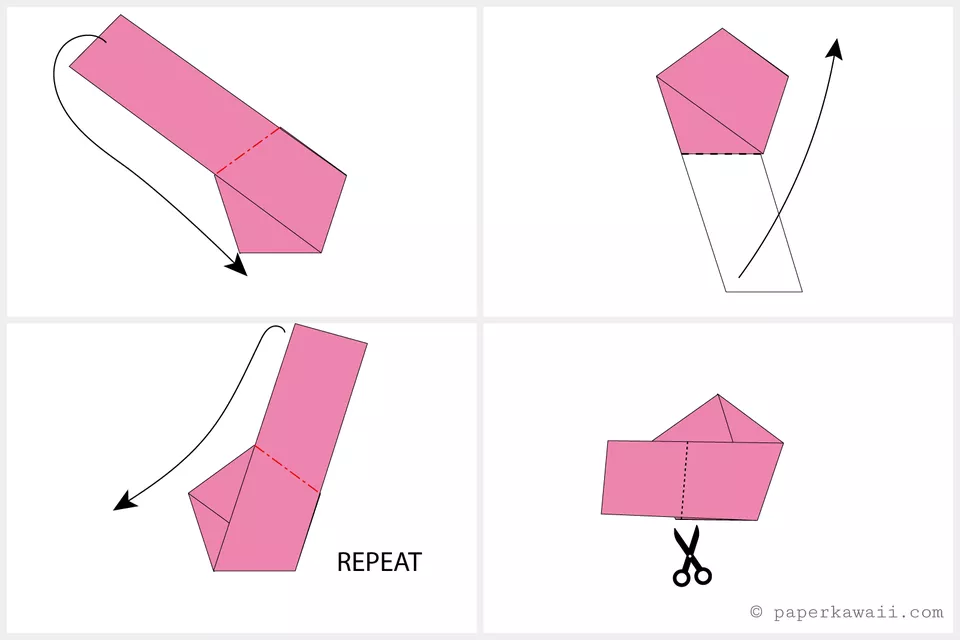
قدم سوم:
- همچنان به پیچیدن پنج وجهی ادامه دهید
- نوار کاغذی را به طرف پشت و پایین تا بزنید
- تا زدن نوار کاغذی را به طرف پشت و سمت چپ تا جایی ادامه دهید که در بخش سمت چپ تنها تکه کوچکی از کاغذ باقی مانده باشد
- اگر متوجه شدید که طول نوار کاغذی بیش از حد نیاز است به وسیله یک قیچی آن را کوتاه کنید
قدم چهارم:
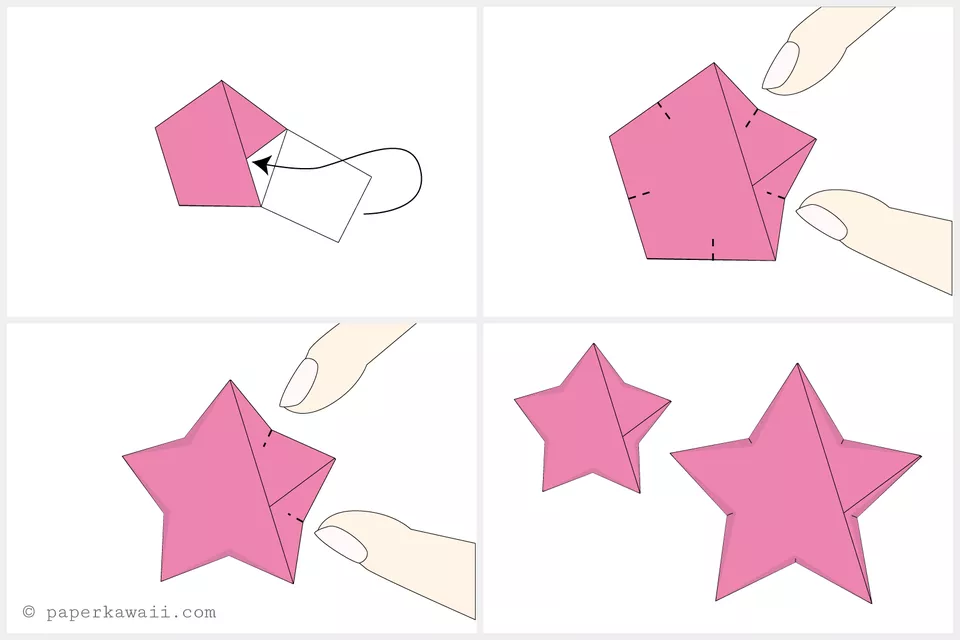
- حالا بخش انتهایی نوار کاغذی را در داخل بخش جیب مانند مدل فرو ببرید تا همان جا بماند
- زمان فرم دادن به مدل است
- با انگشت اشاره و انگشت شست خود دو طرف یکی از ضلع های ستاره را بفشارید
- مدل را بچرخانید و با دو انگشت تمام ضلع های ستاره را فرم دهید
اوریگامی ستاره خوش شانس آماده است!
فراموش نکنید که کار نیکو کردن از پر کردن است، با تمرین و تلاش میتوانید زیبا ترین ستاره ها و شکبل ترین مدل های اوریگامی را بسازید.