باتری چیست ؟ 0 تا 100 انواع باتری

در پاسخ به باتری چیست باید بگوییم باتری مجموعهای از یک یا چند سلول هستند که با ایجاد واکنشهای شیمیایی، انرژی شیمیایی را به انرژی الکتریکی تبدیل میکند و باعث جریان الکترونها درمدار میشوند. تمام آنها از سه جزء اصلی ساخته شدهاند:
آند (طرف -)، کاتد (طرف +) و بعضی از انواع الکترولیت (مادهای که با آند و کاتد واکنش شیمیایی ایجاد میکند).
وقتی باتری به یک مدار الکتریکی متصل میشود، واکنش های شیمیایی در الکترولیت رخ میدهند و الکترون ها از قطب منفی به قطب مثبت جابجا میشوند. این جابجایی الکترون ها باعث ایجاد جریان الکتریکی در مدار میشود.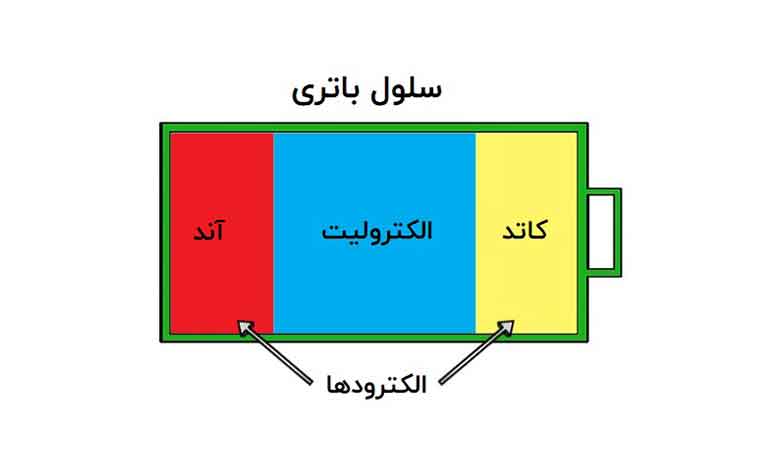
اگر باتریها وجود نداشتند، کوادکوپتر (پرنده بیسرنشین 4 ملخه – quadcopter) را باید به دیوار متصل میکردید، یا مجبور بودید خودروتان را مانند قدیم با هندل دستی روشن میکردید یا بدتر از آن دسته بازی Xbox همیشه باید با یک سیم به دستگاه متصل میبود. خالی از لطف نیست که اشاره کنیم بدون باتری نمیتوانستید از بستههای آموزشی رباتیک روبویونیک هم استفاده کنید 🙂
باتریها مانند ظرفی قابل حمل برای ذخیره برق هستند. اختراع باتریهای مدرن را به الکساندرو ولتا نسبت میدهند، اما در واقع با یک حادثه بسیار جالب در اثر تشریح یک قورباغه شروع شد.
تاریخچه باتری
چرا آن را باتری نامیدند؟
در طول تاریخ از اصطلاح باتری برای بیان و توضیح مجموعهای از اشیا یا چیزهای مشابه که برای انجام کاری در یک گروه باهم همکاری میکنند، استفاده میشده، مانند رسته آتشبار (در گذشته، یگانهای توپخانه در کنار هم قرار میگرفتند و عملیات را انجام میدادند که به آن Battery of Artillery می گفتند).
در سال 1749 بنجامین فرانکلین (یکی از پدران بنیانگذار ایالات متحده آمریکا، که در تاریخ فیزیک برای کشفها و نظریههایش در مورد برق شناخته شده است) اولین بار از این عبارت (باتری) برای توصیف و بیان یک سری از خازنهایی که برای آزمایش الکتریکی خود به یکدیگر متصل میکرد، استفاده نمود. بعدها این اصطلاح برای تمامی سلولهای الکتروشیمیایی که برای تولید برق به یکدیگر متصل شده بودند، استفاده شد.
اختراع باتری
در سال 1780 یک فیزیکدان، پزشک، زیست شناس و فیلسوف ایتالیایی به نام لوگی گالوانی، یک قورباغهی آویزان از یک قلابِ برنجی را تشریح کرد. هنگامی که پای قورباغه را با یک تیغ جراحی آهنی لمس کرد، پای قورباغه ناگهان تکان خورد. گالوانی در نظریه ای بیان کرد که انرژی لازم برای ایجاد آن تکان از خود قورباغه بوده، ولی یکی از همکارانش به نام آلساندرو ولتا عقیدهای کاملا متفاوت داشت.
ولتا بر این باور بود که تکان خوردن پای قورباغه ناشی از برخورد فلزات خیس بود. وی این آزمایش را با ابزار دیگری امتحان نمود. ولتا برای انجام آزمایش از پارچه خیس شده درون آب و نمک استفاده کرد؛ که نتیجه همان ولتاژ مشابه آزمایش پای قورباغه بود. ولتا یافتههایش را در سال 1791 به چاپ رساند و سپس در سال 1800 اولین باتری را ساخت و آن را پیل ولتا نامید.
پیل ولتا با دو مشکل اساسی مواجه بود:
وزن توده باعث میشد الکترولیت از پارچه چکه کند و خواص شیمیایی اجزا سبب میشد تا نتیجه کار ماندگاری کوتاهی داشته باشد: حدودا یک ساعت! تا دویست سال بعد از آن جریانات، دانشمندان و مهندسان همچنان بر روی افزایش قابلیت باتری ها کار میکردند.
رفع ایرادات پیل ولتا
ویلیام کروشانک (William Cruickshank) از اسکاتلند با قرار دادن پیل ولتا در کنار آن و شکل دادن Trough battery مشکل نشتی و چکه پیل ولتا را حل نمود.
مشکل دوم پیل ولتا دوام کم آن ناشی از تخریب روی بعلت ناخالصیها و ایجاد حبابهای هیدروژنی بر روی مس بود. ویلیام استورگن (William Sturgeon) در سال 1835 کشف کرد که افزودن روی به جیوه از تخریب و پوسیدگی جلوگیری میکند.
جان فردیک دنیل ( (John Frederic Daniell شیمیدان بریتانیایی از دومین الکترولیت که با هیدروژن واکنش میداد برای جلوگیری از ایجاد کاتد یا همان الکترود منفی بر روی مس استفاده نمود. باتریهای دو الکترولیتی ساخته شده توسط آقای دنیل، سلول دنیل (Daniell Cell) نام گرفتند. این باتریها به راه حل مناسب و متداولی برای بهبود قدرت شبکه تلگراف تبدیل شدند.
مواد لازم برای ساخت باتری چیست؟
این سوال را میتوان به چندین زاویه پاسخ داد. باتری ها از سه جزء اصلی ساخته شده اند: یک آند (قطب منفی)، یک کاتد (قطب مثبت) و یک الکترولیت (ماده شیمیایی که بین آند و کاتد قرار میگیرد و واکنش های شیمیایی را امکان پذیر میکند). باتری ها را میتوان براساس نوع الکترودها و الکترولیت هایشان به دسته های مختلف تقسیم کرد.
مراحل ساخت باتری چیست؟
باتری یک دستگاه است که کار او تبدیل انرژی است. باتری ها در بسیاری از دستگاه های الکترونیکی، مانند تلفن های همراه، لپتاپ، ساعت، رادیو و خودروهای برقی کاربرد دارند. بسته به نوع باتری، این مراحل ممکن است تفاوت داشته باشند. اما به طور کلی، مراحل ساخت باتری عبارتند از:
• آماده سازی اسلار: در این مرحله، مواد فعال، بایندر و رسانا را با هم در نسبت جرم خاص با هم مخلوط کرده و گوشت های به نام اسلار تولید میکنند.
• کوتینگ و خشک کردن: در این مرحله، اسلار را روی گیره های فلزات قابل جابجای (current collector) پخش کرده و در دمای مناسب خشک میکنند.
• کلندرینگ: گیره های فلزات قابل جابجای پوشیده شده با اسلار را با استفاده از چکش گیرانده و ضخامت و سختي آنها را تغيير مي دهند.
• برش ـ پانچ: صفحات الکتروشيميائی را با استفاده از قالب های خاص بریده و شكل داده مي شوند.
• مونتاژ: در مرحله مونتاژ صفحات الکتروشيميایی را به هم چسبانده و در داخل بدنه باتري قرار مي دهند.
• تزريق الكتروليت: به گونه ای است که خانه های باتري با الكترو ليت پُر مي شوند و سپس باتري را شارژ مي كنند.
• بسته بندی:و آخرین مرحله در ساخت باتری چیست ؟باتری های ساخته شده را در پالت های چوبی یا پلاستیکی قرار می دهند و برای حمل و نقل آماده میکنند.
اجزا باتری
همانطور که قبلتر گفتیم باتری ها از سه جزء اصلی تشکیل میشوند: آند، کاتد و الکترولیت.
اگر الکترولیت کافی نباشد، یک جداکننده (Separator) مسئول آن است که آند و کاتد با هم برخورد نکنند. برای ذخیره کردن این اجزا در یک باتری معمولا از نوعی پوشش استفاده میشود.
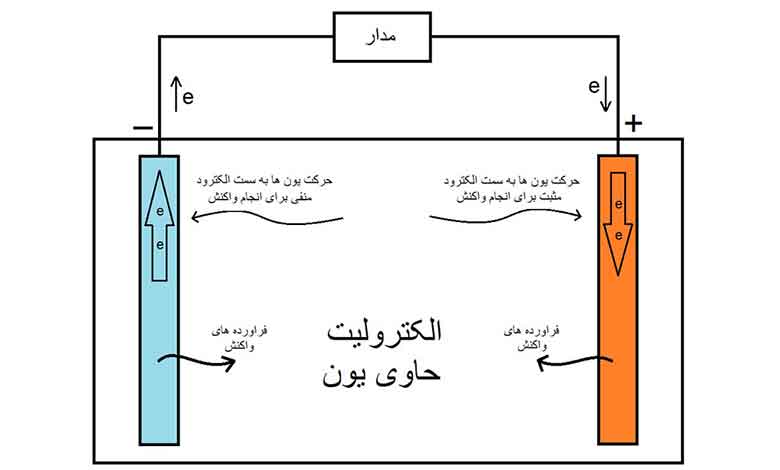
آند و کاتد هردو نوعی الکترود (قطب مغناطیسی) هستند. الکترودها رسانای برق ورودی و خروجی در هر یک از اجزای مدار میباشند.
آند Anode
قطب منفی باتری را آند مینامند. آند جریان الکترونها را از طریق یک دستگاه که به مدار متصل است خارج میکند. بدین معنا است که “جریان” به سمت آند در حرکت است.
واکنشهای شیمیایی میان آند و الکترولیت در یک باتری باعث ایجاد الکترونهایی در آند میشود. این الکترونها میخواهند به سمت کاتد بروند ولی نمیتوانند از سد الکترولیت یا جدا کننده بگذرند.
کاتد Cathode
الکترونها از طریق یک دستگاه که به مدار متصل است به کاتد وارد میشوند. بدین معنا است که “جریان” از کاتد دور میشود.
در باتریها واکنش شیمیایی درون یا دور کاتد از الکترونهایی که توسط آند ساخته شده است استفاده میشود. تنها راهی که الکترونها میتواند به کاتد برسد از طریق یک مدار مجزا از باتری است.
الکترولیت Electrolyte
منتقل کننده یونها در واکنشهای شیمیایی میان آند و کاتد است، الکترولیتها معمولا مایع یا به شکل ژل هستند. الکترولیت همچنین مانع جریان الکترونها میان آند و کاتد میشود، تا الکترونها به راحتی در مدار خارجی جریان پیدا کنند نه در خود الکترولیت.
جداکننده Separator
جداکننده ماده ای منفذ دار است که از برخورد آند و کاتد جلوگیری میکند، و مدار کوچکی در باتری ایجاد میکند. جدا کنندهها را از چیزهای مختلفی میسازند مانند کتان، پلاستیک، پلیستر، مقوا و پلیمر صنعتی. جداکنندهها با آند، کاتد یا الکترولیتها واکنش شیمیایی ندارند.
یونهای موجود در الکترولیت میتوانند با بار منفی و مثبت شارژ شوند و در اندازههای گوناگونی مورد استفاده قرار گیرند.
پوشش Casting
اکثر باتریها به پوششی برای نگه داری اجزا و محتویات شیمیایی خود نیاز دارند. پوشش رابا نام “خانه” یا “پوسته” نیز میشناسند. در کل به هر آنچه که محتویات سازنده یک باتری را در خود به طور منسجم نگه دارد پوشش گفته میشود.
پوشش باتری را میتوان تقریبا با هر چیزی ساخت، برای مثال: پلاستیک، استیل، ورقههای چند لایه پلیمر نرم و غیره. در ساخت بیشتر باتریها از استیل استفاده میشود زیرا از لحاظ الکتریکی به یکی از الکترودها متصل میشود.
عملکرد باتری
باتریها به طور معمول برای آنکه کار کنند به چندین واکنش شیمیایی نیاز دارند. حداقل یک واکنش درون یا اطراف آند و یک یا چند واکنش اطراف کاتد رخ میدهد. الکترونهایی که نتیجه واکنش آند هستند را oxidation (اکسیده شدن) و الکترونهای حاصل از واکنش کاتد را reduction (کاهش) مینامند.
اکسیده شدن آند
اکسیده شدن اولین قسمت واکنش ردو (redox) میان آند و الکترولیت است که نتیجه تولید الکترونهای منفی است.
بعضی از واکنشهای اکسید شدن باعث تولید یون میشود، مانند باتری لیتیوم-یون.
کاهش کاتد
کاهش، نیمی دیگر از واکنش ردو (redox) است که درون یا اطراف کاتد رخ میدهد. در برخی از باتریها (مانند باتری لیتیوم-یون) لیتیوم-یونهای حاصل از واکنش اکسید شدن درطول فرایند کاهش با بار مثبت شارژ میشوند.
جریان الکترون
در برخی از باتریها حتی در صورت متصل نبودن باتری به مدار، برخی یا تمام واکنشهای شیمیایی همچنان اتفاق میافتند. این واکنشها به ماندگاری و طول عمر باتری آسیب وارد میکند.
این واکنشها تنها زمانی رخ میدهند که مدار رسانای الکتریکی کاملا میان آند و کاتد قرار بگیرد. هر چه مقاومت میان آند و کاتد کمتر باشد، الکترونهای بیشتری میانشان در جریان خواهند بود و در نتیجه واکنشها سریعتر اتفاق خواهند افتاد.
برخی از انواع پرکاربرد باتری ها عبارتند از:
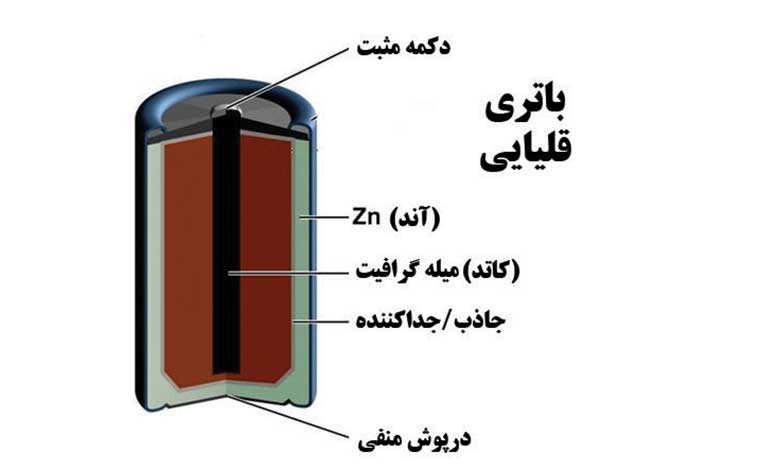
• باتری قلمی: این نوع باتری از جنس منگنز اکسید (MnO2) به عنوان کاتد و روی (Zn) به عنوان آند ساخته شده است. الکترولیت آن محلول قلیایی پتاسیوم هیدروکسید (KOH) است.
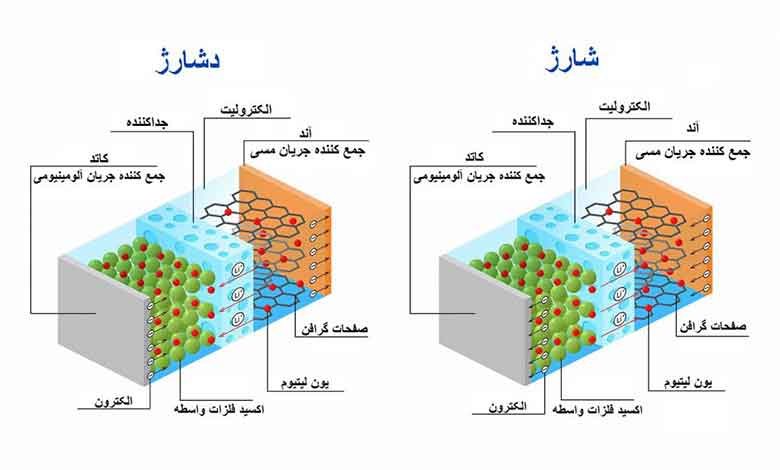
• باتری لیتیوم-یون: این نوع از باتری ها که از جنس لیتیوم کبالت اکسید (LiCoO2) به عنوان کاتد و گرافیت (C) به عنوان آند ساخته شده است. الکترولیت آنها نیز محلول آلی حاوی ژل لیتینگ است.
• باتری سرب-اسید: از جنس سرب دیاکسید (PbO2) به عنوان کاتد و سرب خالص (Pb) به عنوان آند ساخته شده است. الکترولیت این نوع باتری محلول اسید سولفوریک (H2SO4) است.
سلولهای جامد
تا سال 1800 الکترولیتهای درون باتری مایع بودند،که حمل و جابهجایی باتریها نیاز به دقت بسیاری داشت و کار ریسک پذیری بود، بعضی از انواع باتریها نیز ثابت بودند و پس از اتصال به مدار هیچگاه نباید جابهجا میشدند.
در سال 1866 ژُرژ لکلانژ (مهندس برق فرانسوی) با استفاده از یک آند از جنس روی، یک کاتد دیاکسید منگنز و یک محلول آمونیاک کلرید برای الکترولیت، یک باتری ساخت. با وجود اینکه الکترولیتهای باتری لکلانژ هنوز مایع بودند، ماهیت شیمیایی باتریها ثابت کردند که یک گام مهم در جهت اختراع باتری خشک برداشته است.
کارل گاسنر نحوه ایجاد یک الکترولیت خارج از کلرید و گچ پاری (Plaster of Paris) را کشف کرد. وی در سال 1886 در آلمان باتری خشک جدیدی را معرفی کرد.
این باتریهای خشک جدید را معمولا با نام باتریهای روی-کربن میشاختند. این باتریها تا اواخر دهه 50 بسیار محبوب شدند و به فروش بسیار زیادی دست پیدا کردند.
باوجود این که کربن واکنش شیمیایی ندارد، ولی نقش بسیار مهمی در باتری روی-کربن به عنواد یک رسانای الکتریکی ایفا میکند.
در دهه50 لویس اُری، پاول مارسل و کارل کُردش از Union Carbide)) اتحادیه کاربید (که بعدها با عناوین Everyday و Energizer شناخته شدند) الکترولیت آمونیاک-کلرید را با یک ماده قلیایی جایگزین کردند؛ این ماده قلیایی بر اساس فرمول شیمیایی باتری توسط والدمیر جانگز در سال 1899 ساخته شده بود.
در دهه 60 باتریهای قلیایی به سرعت معروف شدند زیرا میتوانستند انرژی بیشتری نسبت به باتریهای کربن-روی در همان اندازه در خود نگه دارند و طول عمر مفیدشان بیشتر شده بود.
نخستین باتریهای قابل شارژ
در سال 1859 گاستون پلانته یک فیزیکدان فرانسوی، با استفاده از دو ورق لولهای سرب خوابانده در اسید سولفوریک یک باتری ساخت. با برعکس کردن جریان الکتریکی در باتری، کنشهای شیمیایی به حالت اولیه خود باز میگردند، با این روش نخستین باتریهای قابل شارژ ساخته شدند.
بعدها، کامیل آلفونس فاور در سال 1881 ورقههای لولهای را تبدیل به ورقههای مسطح نمود و با این اقدام کار تولید باتریها قابل شارژ را بهبود بخشید.
چگونه باتری های قابل شارژ را بازیافت کنم؟
باتری های قابل شارژ برای محیط زیست بهتر از باتری های یک بار مصرف هستند، زیرا تعداد کمتری از آن ها استفاده می شود و زباله کمتری تولید می کنند.
با این حال، باتری های قابل شارژ نیز حاوی مواد سمی و فلزات سنگین هستند که در صورت نشت یا دفع نادرست، محیط زیست و سلامت انسان را به خطر می اندازند. بنابراین، باتری های قابل شارژ را نباید در سطل زباله دور ریخت، بلکه باید به صورت صحیح بازیافت شوند.
• اولین گام، تشخیص نوع باتری است. باتری های قابل شارژ معمولاً علامت گذاری شده اند که نشان دهنده نوع الکتروشيميایی آن ها است. بعضي از انواع آنها عبارتند از ليتيوم يون، سولفور سديم ، سرب اسيدي و روی – کربن.
• دومین گام، جداسازی باتری های قابل شارژ از باتری های یکبار مصرف است. باتري ها را در جهت صحيح قرار دهيد و قطب هاي منفي و مثبت را با دقت رعايت كنيد. باتري ها را با يكديگر يا با فلزات ديگر تماس ندهيد و از قرار گيري در جعبه ها يا كيف ها جلوگيري كنيد.
• سومین گام، پیدا کردن یک مکان مناسب برای بازیافت باتری است. در کشورهای خارجی، معمولاً مکان های مخصوصی برای جمع آوری و بازیافت باتری ها وجود دارند که می توانید آن ها را در فروشگاه ها، مدارس، کتابخانه ها یا سایر مکان های عمومی پیدا کنید. در ایران، ممکن است چنین مکان هایی کمتر یافت شوند، اما بعضی از شرکت های تولید کننده باتری، قابلیت بازگشت باتری های خراب را ارائه می دهند.
• چهارمین گام در بازیافت باتری چیست؟ تحویل دادن باتری ها به مکان بازیافت است. باتري ها را در جعبه يا كيسه اي قرار دهيد و به مكان بازيافت منتقل کنید. اگر مكان بازيافت نزدیکی سراغ ندارید، مي توانيد باتری ها را به پست بفرستيد . اما قبل از این کار، باید اطمینان حاصل کنید که قطب های باتری را با نوار چسب پوشانده اید تا از خطر اتصال کوتاه جلوگیری کنید.
سلولهای باتری
به آند یا یک کاتدی که به وسیله الکترولیت برای تولید ولتاژ و جریان برق مورد استفاده قرار گرفته است و از هم جدا شدهاند، سلول گفته میشود. با یک یا چند سلول میتوان یک باتری ساخت، برای مثال باتری AA ،تک سلولی است و باتری مورد استفاده در خودرو شش سلولی.
تک سلولی
برخی از مدارها با باتریهای تکسلولی برقرسانی میشوند، ولی باید بررسی کنید که باتری توان رساندن ولتاژ کافی را داشته باشد. اگر ولتاژ برای مدارتان خیلی زیاد یا خیلی کم باشد به یک مبدل DC/DC نیاز دارید.
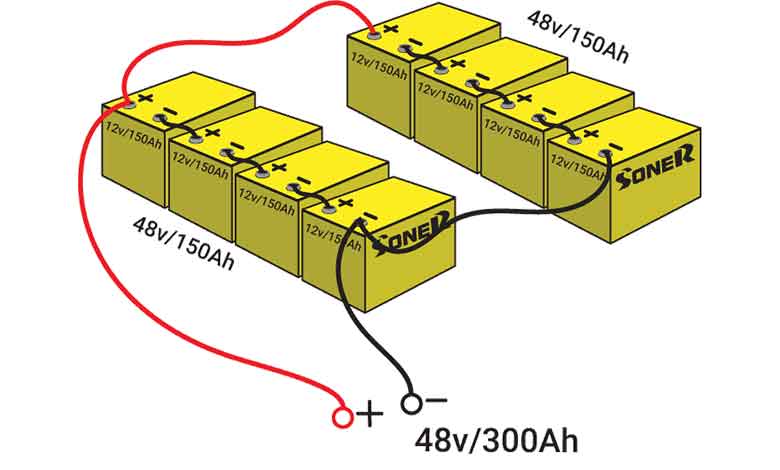
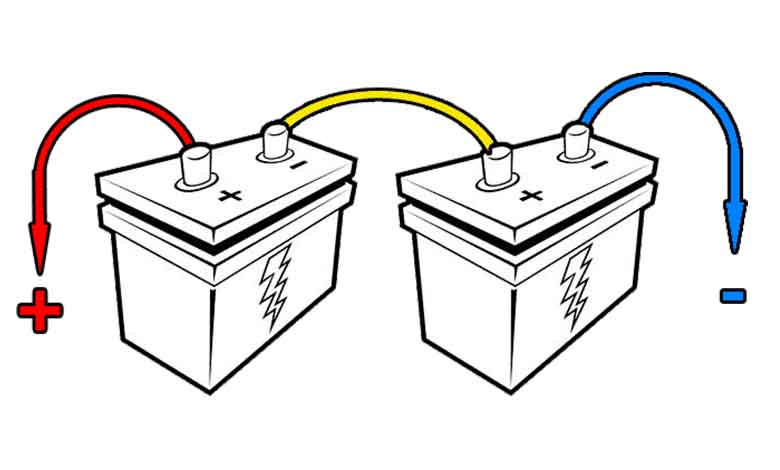
سری سازی باتریها
برای افزایش ولتاژ پایانههای باتری میتوانید سلولها را سری کنید. سری سازی یعنی سلول ها را به هم وصل کنید، اینگونه که آندِ یکی به کاتد دیگری متصل باشد.
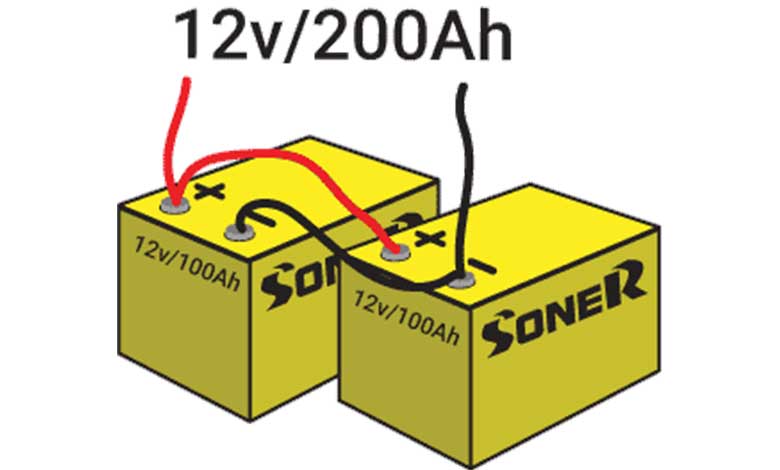
اگر ولتاژ یک سلول برای بار الکتریکی کافی باشد، برای افزایش ظرفیت میتوانید باتریها را به طور موازی به هم وصل کنید، که این عمل جریان در دسترس را نیز افزایش میدهد.
اگر میخواهید هم ظرفیت و هم ولتاژ را افزایش دهید، باتریها را به هر دو روش موازی و سری به هم متصل کنید. روش موازی را با حرف p و روش سری را با حرف S نشان میدهند.
تفاوت باتری ماشین با باتری ساعت
باتری ماشین با باتری ساعت چندین تفاوت دارند که در زیر به برخی از آنها اشاره میکنم:
• باتری ماشین از نوع سرب-اسید است که یک باتری ثانویه یا قابل شارژ است . معنی این ویژگی باتری چیست؟ این بدان معناست که میتوان با وارد کردن جریان الکتریکی به آن، انرژی شیمیایی ذخیره شده در آن را بازیابی کرد. باتری ساعت از نوع قلمی است که یک باتری اولیه یا غیرقابل شارژ است. یعنی وقتی انرژی شیمیایی آن تمام شود، دیگر نمیتوان آن را شارژ کرد و باید تعویض شود.
• باتری ماشین دارای ولتاژ 12 ولت است که با توجه به تعداد سلول های الکتروشیمیایی آن تعیین میشود. هر سلول دارای ولتاژ 2 ولت است و در باتری ماشین 6 سلول به صورت سری به هم متصل هستند. باتری ساعت دارای ولتاژ 1.5 ولت است که با توجه به جنس الکترودها و الکترولیت آن تعیین میشود.
• باتری ماشین دارای ظرفیت بالای آمپر-ساعت است که وظیفه اش نشان دادن حجم انرژی است. به عنوان مثال، یک باتری ماشین ممکن است دارای ظرفیت 60 آمپر-ساعت باشد یعنی میتواند در صورت استفاده از 5 آمپر جریان، 12 ساعت عمل کند.
مقایسه شرکت های تولید کننده باتری
متأسفانه، نمیتوانیم به طور مستقیم در مورد مقایسه شرکتهای تولید کننده باتری کمک کنیم .زیرا وابسته به عوامل متعددی است که شامل کیفیت، عمر مفید، قدرت، قابلیتها و قیمت باتریها میشوند. هر شرکت ممکن است در یک یا چندین نوع باتری بهتر عمل کند.
برخی از شرکتهای معروف تولید کننده باتری عبارتند از:
– دوراستار
– پاناسونیک
– انرژایزر
– دوراچل
– سان دیسک
شرکت های ساخت باتری را می توان براساس نوع الکتروشيميایي، ظرفيت ، قيمت، كيفيت و كاربردهاي آن ها مقايسه كرد. بعضي از نوع الكتروشيميایي ها عبارتند از ليتيوم يون سولفور سديم ، سرب اسيدي و روي-كربن .
ظرفيت يك باتري نشان دهنده حجم انرژي است كه يك باتري مي تواند ذخيره كند.عوامل موثر بر قیمت قيمت باتری چیست؟ هزينه توليد يا خريد آن، كيفيت در عملکرد، پايداري، امنيت و عمر آن است همچنین كاربردهاي يك باتری بیان کننده زمينه ها و صنايعی است كه از آن استفاده مي شود.
کشورهای معروف در ساخت باتری
رتبه چین در تولید باتری چیست؟ چین تولید کننده باتری های لیتیوم یونی برای خودروهای هیبریدی و برقی – دارای بالاترین سهم بازار در سال 2021 با 32.5 درصد – مشتریان شامل تسلا، ولوو، هوندا و دیگران.
کره جنوبی تولید کننده باتری های لیتیوم یونی برای خودروهای هیبریدی و برقی، تجهیزات الکترونیکی و انرژی های تجدیدپذیر – دارای دومین سهم بازار در سال 2021 با 21.5 درصد – مشتریان شامل فورد، رنو، جنرال موتورز و دیگران.
علت معروف شدن ژاپن در تولید باتری چیست؟ ژاپن تولید کننده باتری های لیتیوم یونی برای خودروهای هیبریدی و برقی، تجهیزات الکترونیکی و انرژی های تجدیدپذیر – دارای سومین سهم بازار در سال 2021 با 14.7 درصد – مشتریان شامل تسلا، تويوتا، نيسان و …
رابطه سلامتی انسان با باتری چیست؟
باتری ها برای سلامت انسان خطرات مختلفی دارند که به برخی از آن ها اشاره می کنم:
• باتری ها ممکن است حاوی مواد سمی و فلزات سنگینی باشند که در صورت نشت، تماس با پوست، خوردن یا استنشاق می توانند باعث مسمومیت، آسیب به اعضای حیاتی، سرطان و مرگ شوند. برخی از این مواد عبارتند از سرب، جیوه، کادمیوم، نیکل و لیتیوم.
• باتری ها ممکن است باعث افزایش دمای محیط شوند که می تواند خطر آتش سوزی را افزایش دهد. باتری های لیتیوم یون به خصوص در صورت آسیب دیدگی، شارژ نادرست یا باردهی زیاد ممکن است دچار اختلال شده و منفجر شوند.
• باتری ها ممکن است باعث آلودگی آب و خاک شوند که می تواند به زیرزمین و چاه های آب راه یابد و به سلامت انسان و حیوانات آسیب برساند. باتری های سرب اسید به خصوص در صورت نشت الکترولیت، محلول اسید سولفوریک را تولید می کنند .
جهت استفاده از باتری این نکات را رعایت کنید
• ویژگی محیط مناسب برای نگهداری باتری چیست؟ باتري ها را در جاي خشك و خنك نگه داريد و از قرار گيري در نزديكي منابع حرارتي و شعله جلوگيري كنيد.
• باتري ها را در جهت صحيح قرار دهيد و قطب هاي منفي و مثبت را با دقت رعايت كنيد.
• باتري ها را با دستگاه هاي مناسب شارژ كنيد و از شارژ بيش از حد يا كم جلوگيري كنيد.
• باتري ها را در دستگاه هاي الكترونيكي قديمي يا خاموش نگذاريد و در صورت عدم استفاده طولاني مدت آن ها را جدا كنيد.
• باتري ها را با يكديگر يا با فلزات ديگر تماس ندهيد و از قرار گيري در جعبه ها يا كيف ها جلوگيري كنيد.
• باتري ها را به كودكان ندهيد و از خوردن يا لمس دهان آن ها جلوگيري كنيد.
نتیجه گیری:
با توجه به اینکه نوع باتری چیست، مانند قلمی، قابل شارژ و…، بهتر است نظرات و بررسیهای متخصصان در این زمینه را بررسی کنید و مشخصات فنی هر شرکت را مقایسه کنید تا بهترین انتخاب را داشته باشید و بسیار مواظب باشید که باتری را چگونه دور میریزید و در کجا نگه داری میکنید.
علاوه بر این، دیگر این را می دانیم که مصرف باتری های قابل شارژ برای خود انسان و محیط زیست مناسب تر است.