آزمایش نشان دادن جاذبه بین مولکول های سطح آب

جاذبه بین مولکولی یکی از اصول بنیادی در دینامیک مواد است که نقش کلیدی در خصوصیات و رفتار مواد ایفا می کند. این نیروی جاذبه، تأثیرات بسیاری در زمینه های مختلف از جمله شیمی، فیزیک، و مهندسی مواد دارد. در این مقاله قصد داریم در خصوص آزمایش نشان دادن جاذبه بین مولکول های سطح آب بحث و بررسی کنیم.
جاذبه بین مولکولی یک موضوع پیچیده و مهم است که تأثیرات عظیمی بر خواص و رفتار مواد دارد. درک عمیق تر از این نیروها، امکان بهینه سازی و کنترل بهتر خواص مواد را فراهم کرده و در توسعه فناوری های مواد نقش کلیدی ایفا می کند. در ادامه به تشریح برخی از جاذبه های بین مولکولی می پردازیم.
پیوند یون ـ دوقطبی
پیوند یون ـ دو قطبی یک نوع پیوند الکترونی است که در مولکول ها به وجود می آید و معمولاً بین یک اتم با الکترون های الکترون منفی و اتمی دیگر با الکترون های الکترون جذب شده مثبت (یون) اتفاق می افتد. این پیوند بر پایه تفاوت بارهای الکتریکی بین اتم ها ایجاد می شود و بر مولکول ها با خواص شیمیایی و فیزیکی مختلف تأثیرگذار است.
مکانیسم پیوند یون دو قطبی
در پیوند یون دو قطبی، یک اتم با خاصیت جذب الکترون (عمدتاً یک عنصر نمی تواند) الکترون های الکترون منفی را از اتم دیگری با خاصیت افزایش الکترون (عمدتاً یک فلز) جذب می کند. این اتم ها به ترتیب به نام های یک “یون منفی” و یک “یون مثبت” معروف هستند. این ایجاد یون ها باعث ایجاد نیروی الکترواستاتیکی جذب میان آنها می شود.
خصوصیات پیوند یون دو قطبی
قوی و جامد:
پیوند یون دو قطبی معمولاً نیروی قوی ای است که مولکول را در حالت جامد نگه دارند.
نقطه ذوب و جوش بالا:
به دلیل قدرت نیروهای یونی، مولکول های حاوی پیوند یون دو قطبی دارای نقطه ذوب و جوش بالایی هستند.
مواد الکتریکی:
در حالت جامد، مواد حاوی پیوند یون دو قطبی معمولاً مواد الکتریکی هستند و می توانند جریان الکتریکی را انجام دهند.
کاربردها
ترکیبات یونی:
بسیاری از ترکیبات شیمیایی مانند نمک ها از پیوند یون دو قطبی تشکیل شده اند.
خصوصیات مواد:
پیوند یون دو قطبی در تعیین خصوصیات مواد مانند نقطه ذوب و جوش، هدایت الکتریکی و خواص دی الکتریکی تأثیرگذار است.
فرآیندهای شیمیایی:
در بسیاری از واکنش های شیمیایی، پیوند یون دو قطبی نقش مهمی در ایجاد ترکیبات و محصولات دارد.
پیوند دوقطبی ـ دوقطبی
پیوند دو قطبی ـ دو قطبی یک نوع پیوند میان مولکولی است که در آن دو مولکول با قطبیت های الکترونی مختلف به یکدیگر جذب می شوند. این نوع پیوند اساساً بر اساس تفاوت الکترونگاتیوی بین اجزای مولکول ها ایجاد می شود و به طور عامیانه به عنوان “پیوند هیدروژنی” نیز شناخته می شود.
مکانیسم پیوند دو قطبی دو قطبی
در پیوند دو قطبی دو قطبی، یک مولکول با الکترونگاتیوی بالا (قطب منفی) به مولکولی با الکترونگاتیوی پایین تر (قطب مثبت) جذب می شود. این تعامل میان دو قطب در نتیجه تفاوت الکترونگاتیوی ایجاد می شود.
خصوصیات پیوند دو قطبی دو قطبی:
قوی و تأثیرگذار:
پیوند دو قطبی دو قطبی معمولاً نسبت به پیوندهای دیگر مانند پیوند وان در و لندر محکم تر و تأثیرگذارتر است.
نقطه ذوب و جوش بالا: مولکول های حاوی پیوند دو قطبی دو قطبی دارای نقطه ذوب و جوش بالایی هستند.
پایداری در حالت جامد:
در حالت جامد، این نوع پیوند می تواند ساختار مولکولی را به صورت سه بعدی تثبیت کرده و مواد را پایدارتر کند.
کاربردها:
پروتئین ها و DNA:
پیوند دو قطبی دو قطبی در ساختارهای بزرگ تر مانند پروتئین ها و DNA نقش اساسی دارد.
آب:
پیوند دو قطبی دو قطبی باعث ایجاد خصوصیات منحصر به فرد آب شده و به اثبات استحکام اتصال آب به شکل های مختلف کمک می کند.
مواد آلی:
در ترکیبات آلی، مثل الکل ها و آمین ها، پیوند دو قطبی دو قطبی به صورت فراوانی دیده می شود.
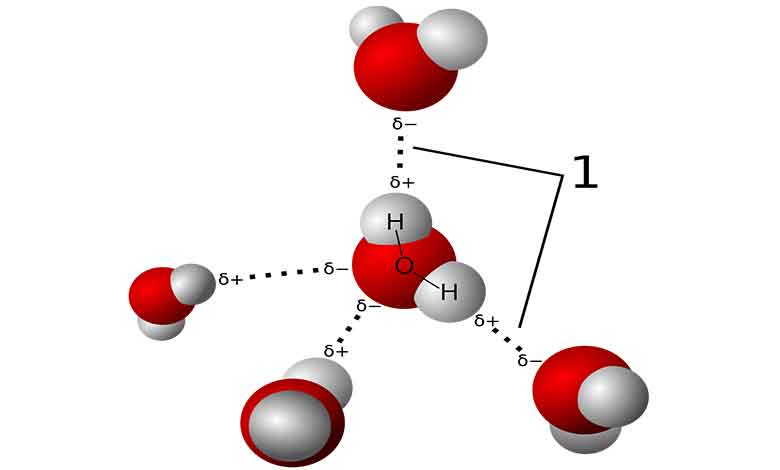
پیوند هیدروژنی
پیوند هیدروژنی یک نوع پیوند میان مولکولی است که بین یک اتم هیدروژن و یک اتم نیتروژن، اکسیژن یا فلزی با الکترونگاتیوی بالا (مثل فلور) ایجاد می شود. این پیوند از اهمیت ویژه ای در تثبیت ساختارهای مولکولی و خواص مواد برخی از مواد آلی و غیرآلی برخوردار است.
مکانیسم پیوند هیدروژنی:
در پیوند هیدروژنی، یک اتم هیدروژن از یک مولکول به الکترونگاتیوترین مولکول دیگر جذب می شود. این اتم هیدروژن معمولاً به یک اتم اکسیژن، نیتروژن یا فلور متصل می شود.
خصوصیات پیوند هیدروژنی:
قوی و انتقال پذیر:
پیوند هیدروژنی نسبت به پیوندهای وان در و لندر به عنوان یک پیوند نسبتاً قوی محسوب می شود.
تأثیر در نقطه جوش و ذوب:
مولکول های حاوی پیوند هیدروژنی نقطه جوش و ذوب بالاتری نسبت به مولکول های مشابه بدون این پیوند دارند.
تثبیت ساختارهای مولکولی:
پیوند هیدروژنی مولکول ها را در ساختارهای خاصی تثبیت می کند و برخی از ویژگی های آنها را تغییر می دهد.
کاربردها:
در زندگی روزمره:
آب به دلیل پیوند هیدروژنی، خصوصیات منحصر به فردی مانند خواص خنک کنندگی، چگالی حداکثر در ۴ درجه سلسیوس، و خواص حلالیت را دارد.
در ساختار DNA و پروتئین:
پیوند هیدروژنی نقش مهمی در ساختار دوپلیکس DNA و تثبیت ساختارهای پروتئینی دارد.
در مواد آلی:
در بسیاری از ترکیبات آلی مانند الکل ها و اسیدها، پیوند هیدروژنی به عنوان پیوند مهمی شناخته می شود.
آزمایش نشان دادن جاذبه بین مولکول های سطح آب
در مطالب بالا به معرفی انواع پیوند های میان مولکول ها پرداختیم، اکنون می خواهیم از طریق یک آزمایش نشان دهیم که جاذبه میان مولکول های سطح آب از کدام نوع جاذبه میان مولکولی است. برای آزمایش نشان دادن جاذبه بین مولکول های سطح آب به موارد زیر نیاز داریم:
- تشتک بزرگ
- تیغ تمیز یا سوزن
- پنس
- قطره چکان
- گرد ذغال
- نمک پاش
- مایع ظرفشویی
مراحل انجام کار :
1- در تشتک بزرگ آب بریزید و با دقت به کمک پنس یک تیغ یا سوزن را روی سطح آب قرار دهید. مشاهده میکنید تیغ یا سوزن روی سطح آب می ماند.
2- چند قطره مایع ظرفشویی کنار تیغ یا سوزن میریزیم.
3- با یک نمک پاش مقداری گرد ذغال را به آرامی در تمام سطح آب میریزیم. مشاهده میکنیم یک لایه نازک زغال در سطح آب به وجود می آید .
4- باز هم چند قطره مایع ظرفشویی روی گرد ذغال میریزیم.
نتیجه آزمایش/چرایی آزمایش :
تیغ یا سوزن به علت کشش سطحی در آب، روی سطح آب شناور می ماند و وقتی مایع ظرفشویی را در کنار تیغ یا سوزن میریزیم مایع ظرفشویی میتواند کشش سطحی آب را از بین ببرد. در نتیجه ی پاره شدن ( پوست نازک) تیغ یا سوزن به درون آب فرو میرود.
لایه نازک زغال به علت کشش سطحی در آب، روی سطح آب شناور می ماند. وقتی مایع ظرفشویی را در سطح آب میریزیم مایع ظرفشویی میتواند کشش سطحی آب را از بین ببرد و در نتیجه ی پاره شدن ( پوست نازک) ذغال به درون آب فرو میرود.
پرسش :
- چرا تیغ یا سوزن و یا گرد ذغال را میتوان به آرامی روی سطح آب قرار داد؟
- مایع ظرفشویی چه نقشی در فرو رفتن تیغ یا سوزن و یا گرد زغال در آّب را دارد؟
- اگر به جای گرد ذغال از یک تکه ذغال استفاده میکردیم چه میشد؟
پاسخ :
- به علت کشش سطحی آب
- کشش سطحی آب را از بین میبرد .
- در آن صورت چون نیروی وزن ذغال بیشتر از نیروی کشش سطحی آب می شد، تکه ذغال آن پوسته نازک را پاره می کرد و در ته ظرف قرار میگرفت.